第二届上海大学十大学术进展候选项目简介
(申报编号:XSJZ-202215)

一、学术进展名称及负责人:
用于肿瘤精准治疗的声动力纳米平台的创建
潘登余(上海大学环化学院化工系教授)
二、项目背景:
声动力治疗(SDT)是近几年开发的一种新型肿瘤治疗方法,原理是利用超声波的非侵入性、超强组织渗透能力以及激发声敏剂产生单线态氧的声动力活性,从肿瘤细胞夺取电子破坏肿瘤细胞的细胞器造成肿瘤细胞的死亡,从而达到准确、彻底杀灭肿瘤而不损伤正常细胞的治疗目的。
制约SDT临床转化的瓶颈在于,声敏剂的综合理化特性尚不能满足SDT的临床需求,需要协同解决如下三个关键问题。1)ROS低产率问题:现有开发的无机纳米声敏剂存在ROS产率低的难题,主要因为它们结构单一,电子空穴对复合严重;2)肿瘤微环境制约:声敏剂应用于SDT不仅受肿瘤乏氧制约而且受GSH高表达制约;3)安全性问题:纳米药物通常结构稳定,尺寸大,不仅难生物降解而且难肾肝外排,体内长期富集存在隐患的问题突出,也是制约无机声敏剂临床转化的一大障碍。因此,理性设计高效安全声敏剂,抑制电子空穴对复合,缓解肿瘤微环境抗性,将是声敏剂开发面临的主要挑战。
三、开展的工作及创新点:
声动力治疗的理化机制尚不清楚,且无机声敏剂的工作原理总是涉及低维半导体材料的能带结构和表界面物理,所以从基础研究的角度看,亟待从半导体物理、纳米生物医学与化工合成相结合的跨学科角度提出综合解决上述问题的原理和方法。基于这个学术思想,本项目提出利用p-n结物理原理设计高效声敏剂的新路线,主要创新点包括:
首次提出了“磷光声敏剂”的概念,设计制备的近红外磷光碳点可以应用于近红外成像介导的精准声动力肿瘤治疗(图1);首次将半导体p-n结概念应用到高效声敏剂的结构设计,提出能带匹配与生物相容原则,精巧构筑可生物降解的p-n结声敏剂(图2);提出构建肿瘤微环境调控的p-n结声敏剂,探索超声介导多机制协同治疗新模式(图3)。
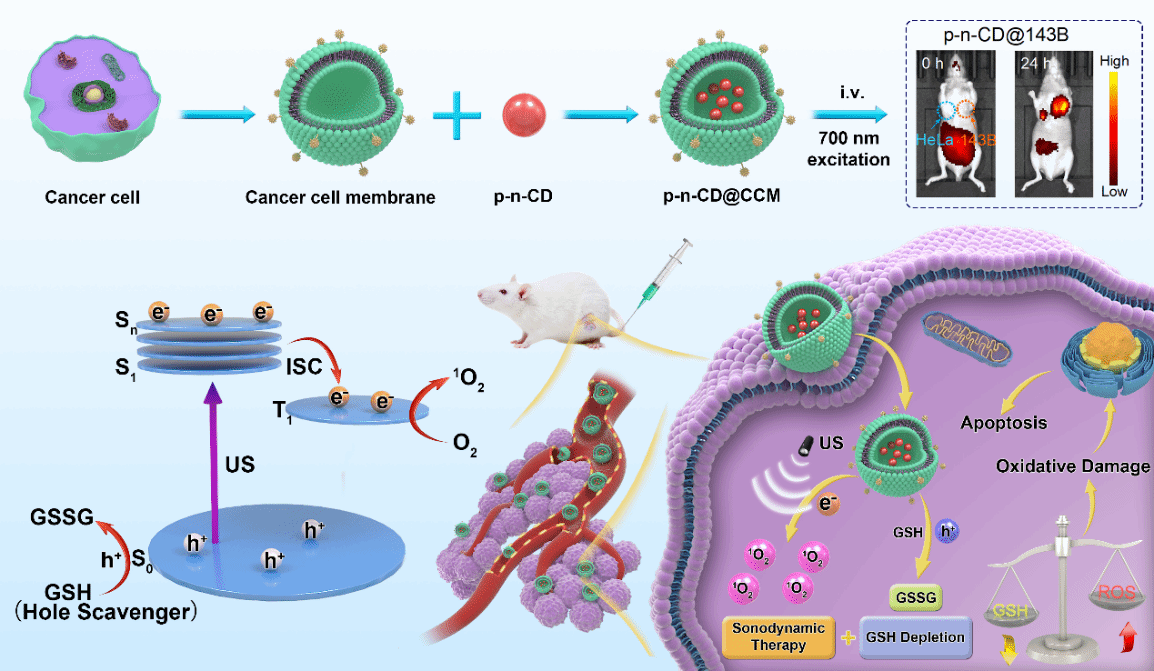
图1近红外磷光碳点用于声动力精准肿瘤治疗。
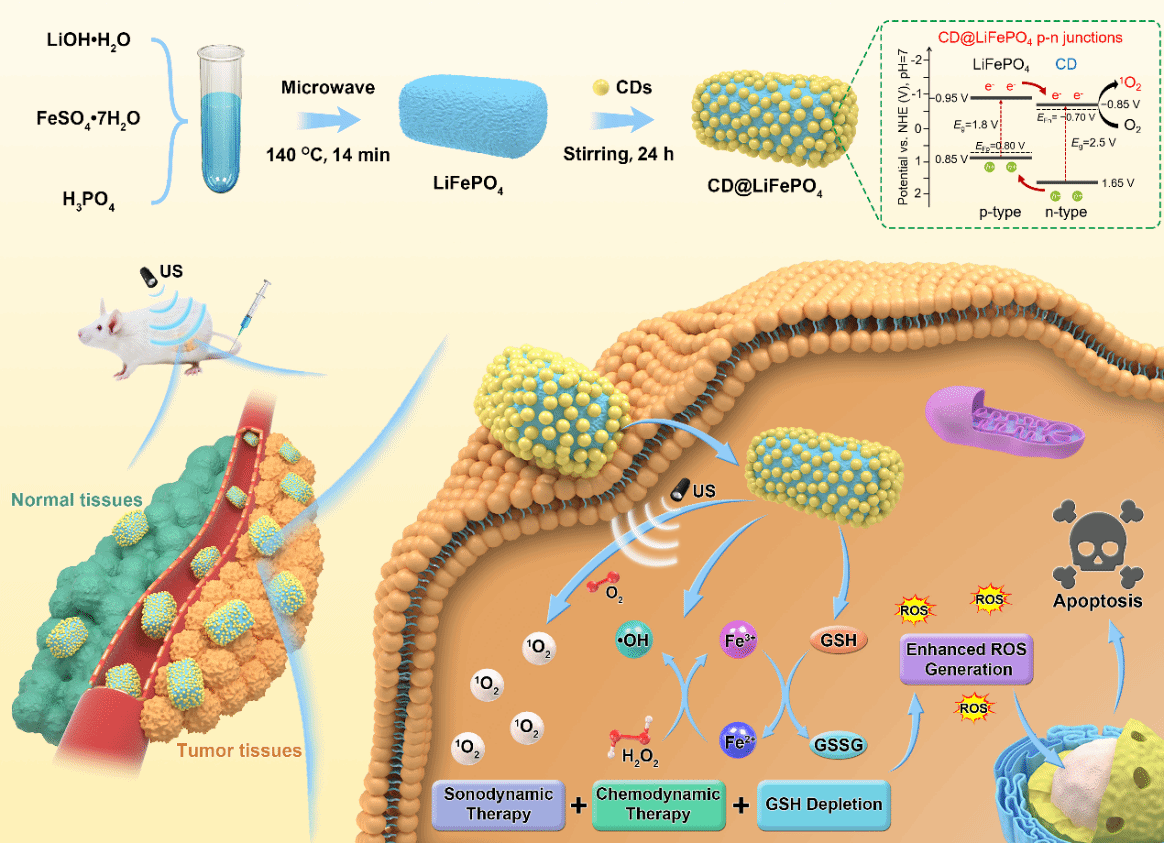
图2可生物降解的p-n结声敏剂用于用于肿瘤微环境调控增强的声动力治疗。
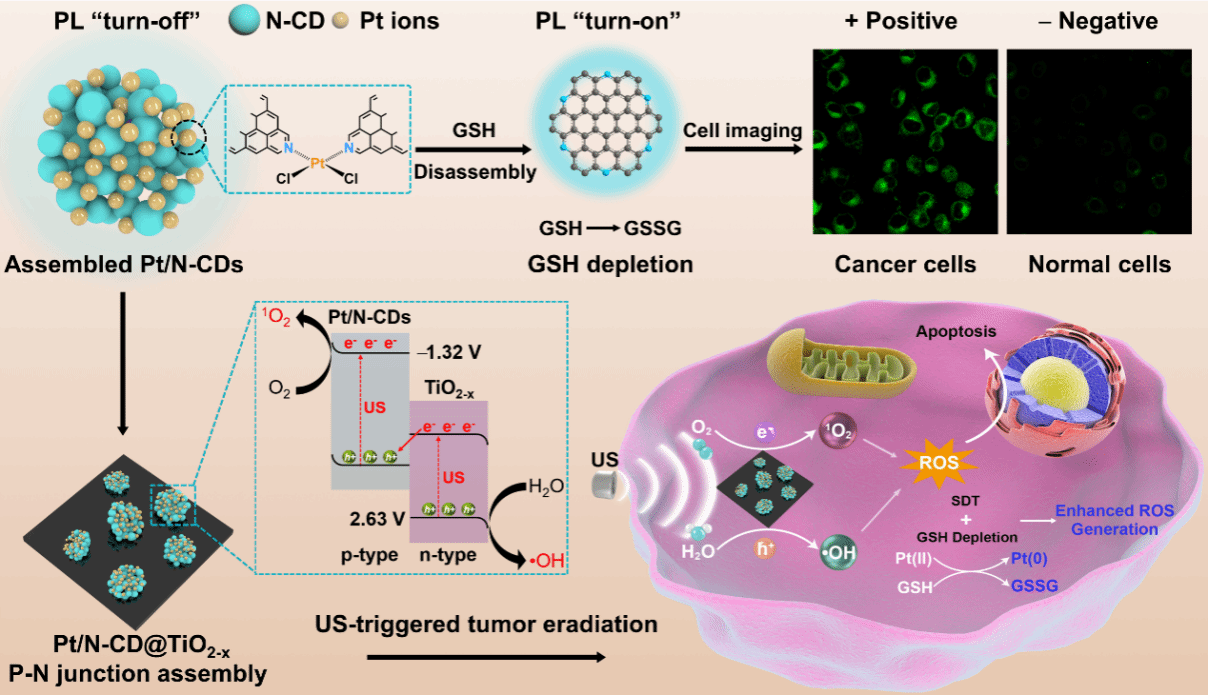
图3新型p-n结声敏剂:Pt交联的碳点@TiO2-x异质结用于肿瘤微环境调控增强的声动力肿瘤根除。
四、研究成果及应用情况、学术及社会影响:
1. 代表性成果(论著、专利及获奖)
(1) Bijiang Geng, Jinyan Hu, Yuan Li, Shini Feng, Dengyu Pan*, Lingyan Feng*, Longxiang Shen*, Near-infrared phosphorescent carbon dots for sonodynamic precision tumor therapy,Nat. Commun., 2022, 13, 5735.
(2) Bijiang Geng, Shirui Zhang, Xue Yang, Wenyan Shi, Ping Li, Dengyu Pan*, Longxiang Shen*, Cu2-xO@TiO2-y Z-scheme heterojunctions for sonodynamic-chemodynamic combined tumor eradication,Chem. Eng. J., 2022, 435, 134777.
(3) Jinyan Hu, Bijiang Geng*, Julie Glowacki, Shirui Zhang, Xue Yang, Dengyu Pan*, Longxiang Shen*, A biodegradable p-n junction sonosensitizer for tumor microenvironment regulating sonodynamic tumor therapy,Chem. Eng. J., 2022, 446, 137320.
(4) Bijiang Geng, Shuang Xu, Ping Li, Xiaokai Li, Fuling Fang, Dengyu Pan*, Longxiang Shen*; Platinum crosslinked carbon dot@TiO2-x p-n junctions for relapse-free sonodynamic tumor eradication via high-yield ROS and GSH depletion,Small, 2022, 18, 2103528.
2. 学术及社会影响
与作用机理类似的放疗和光动力疗法相比,该疗法克服二者缺点,具有肿瘤治疗不受肿瘤类型和位置深浅影响的广谱性,又拥有不伤害免疫系统反而使之增强的安全性。因无机声敏剂工作原理涉及低维半导体的能带结构和表界面物理,本项目从凝聚态物理角度提出解决上述问题的方法和原理。首次探究半导体p-n结调控电子-空穴对分离的物理机制在声动力治疗方面的应用,并提出能带匹配与生物相容原则,精巧构筑高效安全的p-n结声敏剂;同时为克服肿瘤微环境的制约,构建微环境调控的p-n结声敏剂,探索超声介导多机制协同治疗新模式。p-n结声敏剂的研究将开启无机声敏剂研究新领域,有望在治疗难治性癌症方面获得广泛应用。